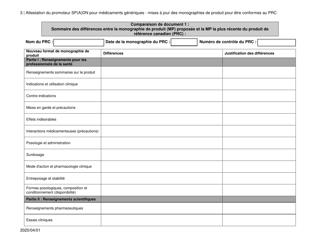
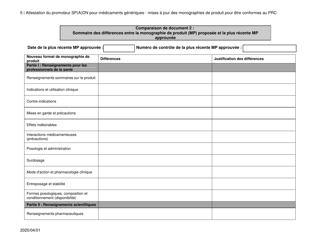
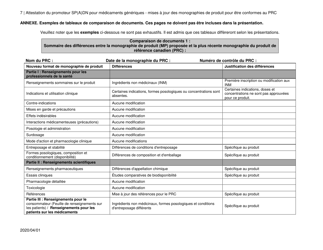
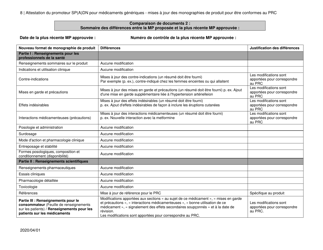
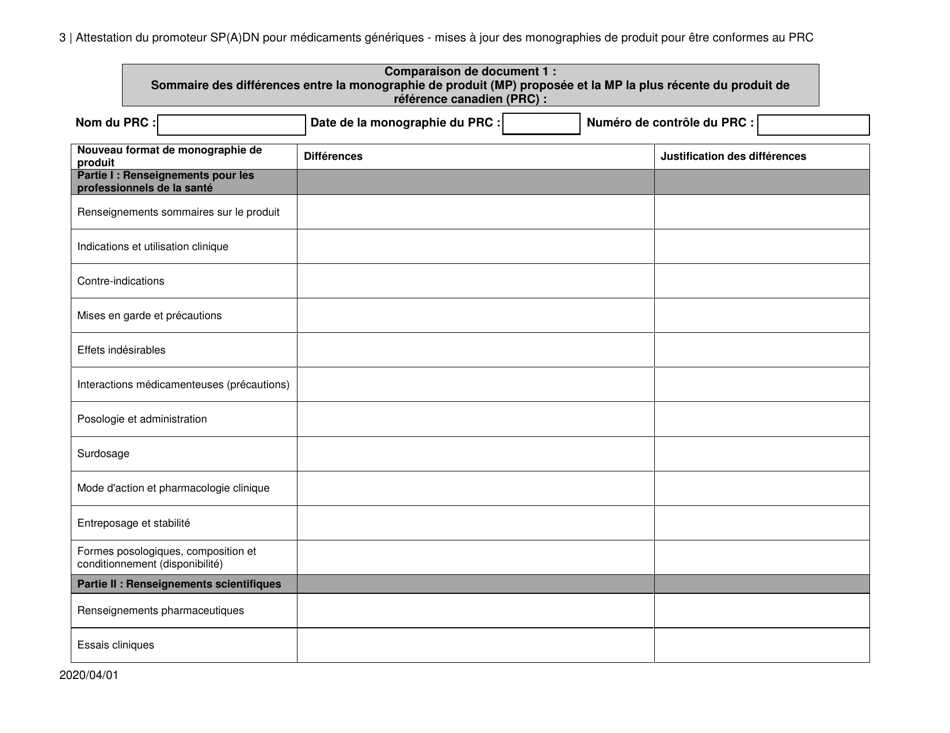
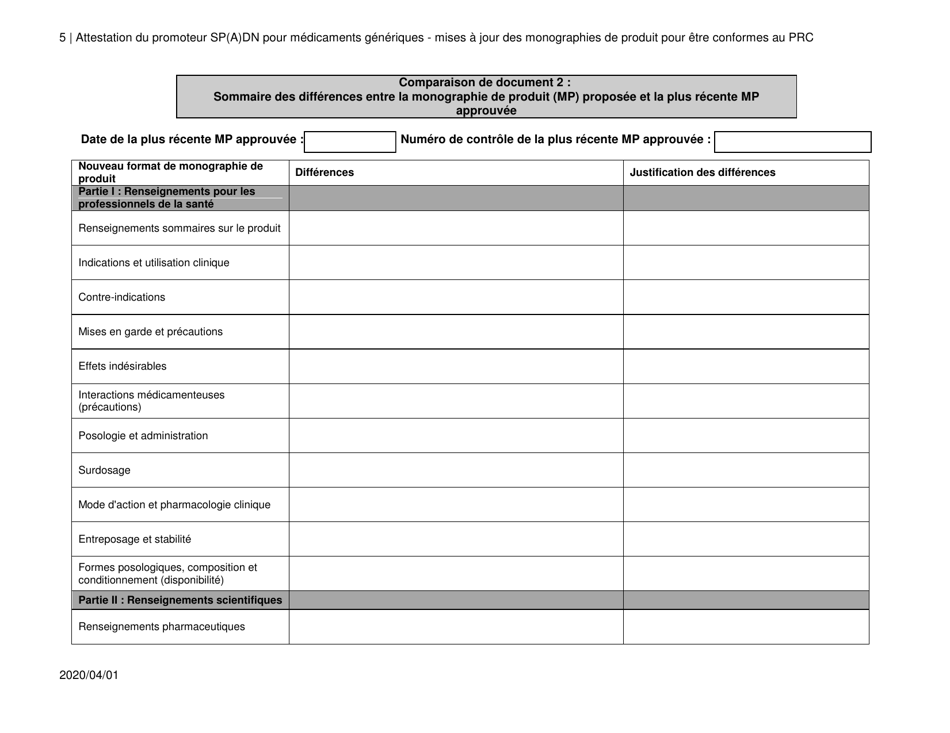
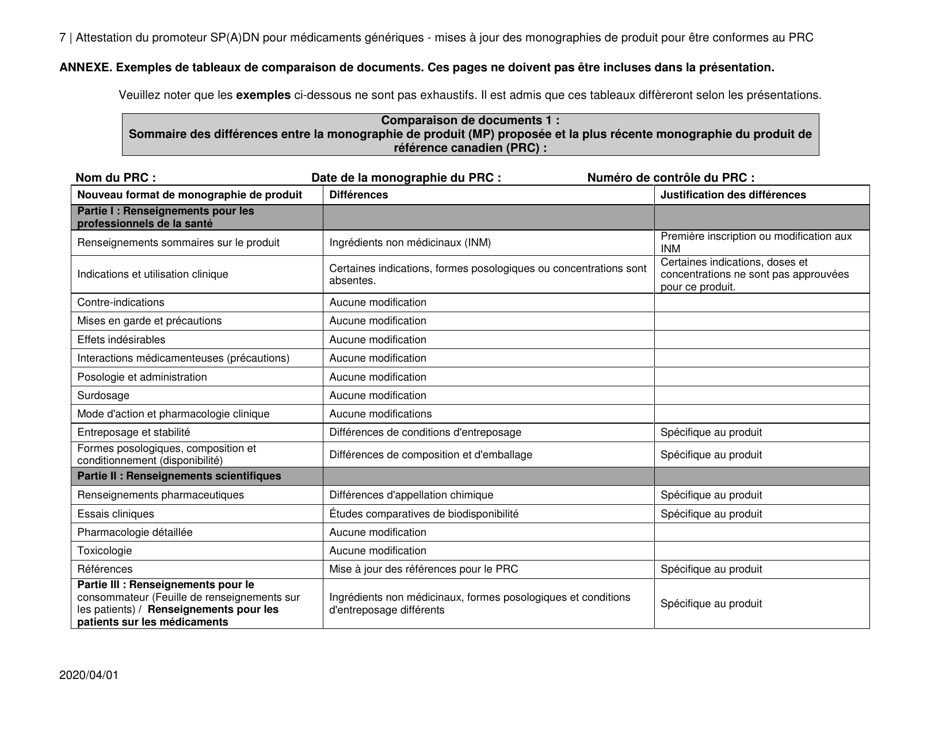
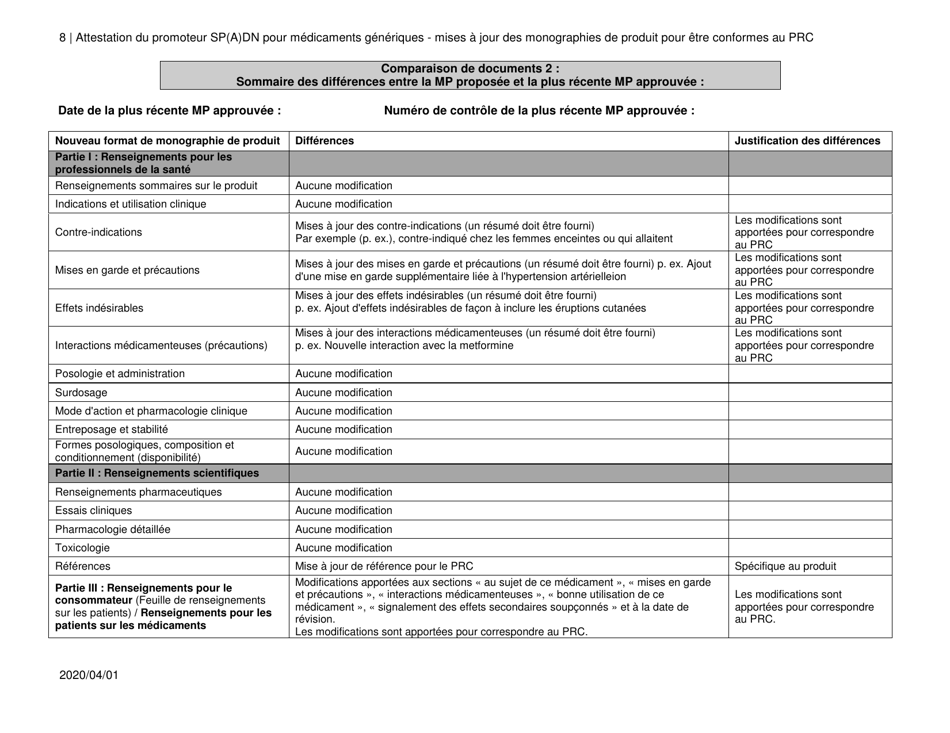
Attestation Du Promoteur Sp(A)dn Pour Medicaments Generiques - Mises a Jour DES Monographies De Produit Pour Etre Conformes Au Prc - Canada (French)
The "Attestation Du Promoteur Sp(A)dn Pour Medicaments Generiques - Mises a Jour DES Monographies De Produit Pour Etre Conformes Au Prc - Canada" is a document in French that relates to updates in the product monographs for generic drugs in Canada. It is a certification provided by the sponsor of generic drugs to confirm that the updates made to the product monographs are in accordance with the regulations.
The attestation du promoteur Sp(A)dn pour medicaments generiques - mises a jour des monographies de produit pour etre conformes au PRC in Canada is typically filed by the drug manufacturer or promoter.
FAQ
Q: What is the purpose of the document?
A: The purpose of the document is to provide updates on product monographs for generic drugs to comply with the Prescription Review Committee (PRC) in Canada.
Q: What is a generic drug?
A: A generic drug is a medication that is similar to a brand-name drug in terms of dosage, strength, route of administration, quality, and intended use.
Q: What is the Prescription Review Committee (PRC) in Canada?
A: The Prescription Review Committee (PRC) in Canada is a regulatory body that assesses and approves drug product monographs for marketed drugs, including generic drugs.
Q: Who is the document intended for?
A: The document is intended for the promoter of generic drugs in Canada.
Q: What is the role of the promoter?
A: The promoter is responsible for ensuring that the product monographs for their generic drugs are updated to comply with the PRC in Canada.
Q: What information is included in the document?
A: The document includes updates on product monographs for generic drugs to comply with the PRC, including any changes in dosage, strength, route of administration, quality, or intended use.
Q: Is this document in French or English?
A: This document is in French.