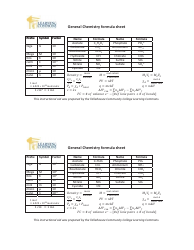
Dat General Chemistry Equation Sheet
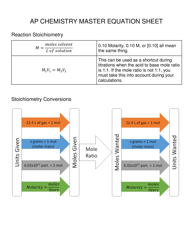
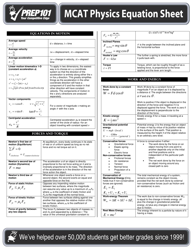
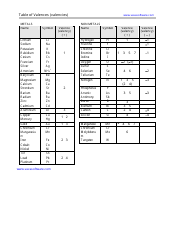
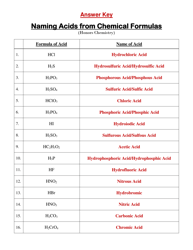
The DAT General Chemistry Equation Sheet is a resource used by those studying for the Dental Admission Test (DAT) to aid in solving chemistry problems. It provides a list of important equations and constants that are commonly used in the general chemistry section of the exam.
FAQ
Q: What is a general chemistry equation sheet?
A: A general chemistry equation sheet is a reference sheet that contains important equations and formulas that are commonly used in general chemistry.
Q: What topics are typically included in a general chemistry equation sheet?
A: A general chemistry equation sheet typically includes topics such as atomic structure, chemical reactions, stoichiometry, gas laws, thermodynamics, and acids and bases.
Q: Is a general chemistry equation sheet allowed during exams?
A: Whether or not a general chemistry equation sheet is allowed during exams depends on the specific exam and the policies set by the instructor. It is best to check with your instructor or the exam guidelines for clarification.
Q: How should I use a general chemistry equation sheet?
A: A general chemistry equation sheet should be used as a helpful reference tool to quickly locate and apply the appropriate equations and formulas when solving problems or answering questions.
Q: Are all equations and formulas included in a general chemistry equation sheet?
A: Not all equations and formulas are included in a general chemistry equation sheet. The sheet typically includes the most commonly used equations and formulas, but it is important to consult your textbook or course materials for a more comprehensive list.
Q: Can I rely solely on a general chemistry equation sheet to learn chemistry?
A: While a general chemistry equation sheet can be a useful tool, it is not a substitute for understanding the underlying concepts and principles of chemistry. It is important to study and practice problem-solving to develop a solid understanding of the subject.
Q: Can I create my own general chemistry equation sheet?
A: Yes, you can create your own general chemistry equation sheet by compiling the equations and formulas that you find important. This can help you personalize the sheet to cater to your specific needs and study style.